MDR1 : Sensibilité Médicamenteuse

L’administration de certains médicaments, même à dose normale, conduit à une neurotoxicité chez les chiens présentant une sensibilité médicamenteuse d’origine génétique.
En effet, lorsque le gêne MDR1 (MultiDrug Resistance) est muté, la protéine correspondante (MDR1-PGP), dont la fonction est d’expulser les molécules toxiques hors du système nerveux central, est inactive. Elle ne peut alors pas remplir sa fonction de neuroprotecteur.
Pour en savoir plus sur le rôle du gène MDR1 chez le chien :
La mutation du gène MDR1 associée à la sensibilité médicamenteuse a été découverte en 2001 par l’équipe de Katrina Mealey de l’Université de l’Etat de Washington. La mutation du gène MDR1 correspond à une délétion de 4 nucléotides dans l’exon 4. Le gène MDR1 code une glycoprotéine-P présente notamment au niveau des cellules endothéliales des capillaires du cerveau qui participent à la barrière hémato-encephalique. Cette glycoprotéine-P est un transporteur transmembranaire qui pompe les molécules toxiques dans les tissus nerveux pour les rejeter dans la circulation sanguine. La mutation du gène MDR1 engendre un codon stop : la glycoprotéine-P est tronquée, elle n’est pas fonctionnelle et n’est plus capable de refouler les molécules médicamenteuses en dehors du cerveau. L’accumulation de molécules toxiques dans le cerveau conduit à une intoxication neurologique.
Les principales molécules à risque
Les molécules à proscrire ou non recommandées :
- Ivermectine (>0.1 mg/kg PO, inj)
- Emodepside
- Loperamide
- Moxidectine (sauf Guardian ND et Advocate ND, qui de par leurs dosages et/ou mode d'administration ne posent pas de problème)
- Doramectine (>0.1 mg/kg PO, inj)
- Abamectine (>0.1 mg/kg PO, inj)
Les molécules à utiliser avec précautions/ surveillance/ modulation de dose éventuelle:

Les signes cliniques
Après l’administration d’un médicament à risque, en fonction de la dose, un chien sensible présente un syndrome neurodépresseur avec les signes cliniques suivants : ataxie, prostration, parésie, hypersalivation, mydriase, amaurose, tremblements, convulsions pouvant conduire au coma ou à la mort par dépression respiratoire.
Le risque d'intoxication
MDR1 +/+ => Homozygote normale => Aucun risque
MDR1 +/- => Hétérozygote => Chien sensible Risque modéré
MDR1 -/- => Homozygote muté => Chien sensible Risque fort
Conseil à la reproduction :
Vous conseillez vos éleveurs de dépister leurs reproducteurs afin d'adapter les accouplements et éviter de faire naître des chiots homozygotes mutés. Pour éviter de dégrader la diversité génétique au sein des races, les chiens hétérozygotes ne doivent pas être exclus de la reproduction.
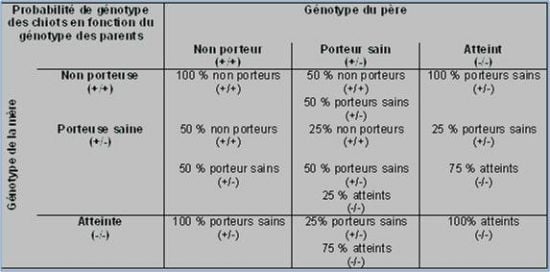
Pour la reproduction du berger blanc, il faudrait s'assurer de ne croiser entre eux que des chiens sains (+/+) ou des porteurs sains (+/-) avec des sujets sains (+/+) car, Si on veut éliminer l'anomalie, on peut admettre tous les accouplements qui ne donneront que des descendants (+/+) ou (+/-)
DM : Myélopathie Dégénérative

Une grave maladie neurologique
La Myélopathie Dégénérative est une dégénérescence de la moelle épinière qui conduit, entre 8 et 14 ans, à une perte de coordination puis à une paralysie progressive des membres postérieurs.
Les premiers symptômes se traduisent par une démarche oscillante et une faiblesse des membres. Le chien traine les pattes, a des difficultés à rester debout et à se déplacer. Le chien devient paraplégique et développe éventuellement une paralysie des membres antérieurs.
Cette maladie peut être confondue avec une hernie discale ou avec une dysplasie de la hanche.
L’éleveur doit protéger son élevage
De nombreuses races de chien sont touchées par cette maladie : Berger Allemand, Berger Blanc Suisse, Berger des Pyrénées, Caniche Shetland, Chien de Rhodésie à Crête Dorsale, Chien Loup de Saarloos, Chien Loup Tchécoslovaque, Colley, Hovawart, Kerry Blue Terrier, Retriever de la Baie de Chesapeake, Terrier Irlandais à Poil Doux, Welsh Corgi Cardigan et Prembroke
Un chien reproducteur qui est porteur sain, ne développe pas la maladie mais la transmet à 50% de sa descendance (maladie récessive). Un éleveur peut accoupler sans le savoir un mâle porteur et une femelle porteuse et engendrer une portée avec des chiots potentiellement atteints qui exprimeront les symptômes tardivement. Un étalon porteur qui se reproduit beaucoup va propager la maladie au sein de la race. La Myélopathie Dégénérative se déclarant très tardivement, tout éleveur peut également reproduire un chien atteint sans le savoir et transmettre la mutation à 100% de sa descendance.
Un test ADN facile à réaliser
A l’aide d’un simple frottis buccal envoyé au laboratoire, l’éleveur effectue un test ADN, le test DM, qui permet de déterminer si le chien testé est homozygote normal (sain), hétérozygote (porteur sain) ou homozygote muté (atteint).
Si le mâle testé est porteur sain, l’éleveur devra alors faire attention d’accoupler ce chien avec une femelle saine afin de ne pas produire de chiots atteints.
Par ailleurs, le résultat, délivré sous la forme d’un certificat génétique valable à vie, permet d’apporter des garanties dans le cadre d’une saillie ou pour justifier la vente de chiots non porteurs de la Myélopathie Dégénérative.
Le vétérinaire qui observe des problèmes d’ataxie ou de paralysie chez un vieux chien peut mettre en œuvre le test DM pour confirmer ou infirmer le diagnostic de Myélopathie Dégénérative. Si le chien est effectivement atteint, les chiots sont obligatoirement porteurs et une attention particulière doit être portée à cette lignée qui présente probablement une proportion plus importante de chiens porteurs.
En conclusion, l’éleveur qui connaît le statut génétique de ses chiens ne prend pas de risque, sécurise son élevage et peut alors sélectionner ses reproducteurs, adapter les accouplements, éviter de faire naitre des chiots atteints et limiter la propagation de cette maladie grave dans l’élevage et dans la race.
Il est donc recommandé de réaliser, sur les principaux reproducteurs, le test ADN de dépistage de la Myélopathie Dégénérative (test DM) qui permet de dépister cette maladie avec une fiabilité supérieure à 99%.
HD-ED Dysplasie Hanche et Coude

La dysplasie de la hanche est une affection orthopédique à transmission héréditaire. Des facteurs environnementaux interviennent aussi dans la manifestation de la maladie. Le dépistage se fait par radiographie des hanches lue par un lecteur officiel, selon le protocole de la FCI.
La radio peut être faite par le vétérinaire habituel du propriétaire, qui certifiera l’identité du chien.
Il ne peut y avoir de lecture officielle sans enregistrement du résultat à la SCC.
Le résultat est une lettre avec la signification ci-dessous, il correspond à l’état de la plus mauvaise des 2 hanches :
HD – A : Aucun signe de dysplasie
HD – B : Stade intermédiaire de dysplasie de la hanche (état sensiblement normal)
HD – C : Dysplasie légère
HD – D : Dysplasie moyenne
HD – E : Dysplasie sévère
La dysplasie du coude (Elbow Dysplasia en anglais, ED) est un terme regroupant plusieurs affections du coude : l’ostéochondrite dissèquante, la non-union du processus anconé, la fragmentation du processus coronoïde médial, l’incongruence articulaire.

Les causes
La dysplasie du coude est une affection héréditaire* mettant en cause plusieurs gènes. D’autres facteurs non génétiques interviennent probablement : surpoids, activité excessive, mauvaise alimentation…
L’évolution
La dysplasie du coude apparaît habituellement entre 4 et 8 mois. Les mécanismes varient en fonction de l’affection :
- Ostéochondrite dissécante : le cartilage de l’humérus ne se consolide pas en tissu osseux et se fissure. Un fragment de cartilage se détache, provoquant douleur et inflammation de l’articulation.
- Non union du processus anconé : le processus anconé est un fragment osseux qui se soude à l’ulna (cubitus) vers l’âge de 4-5 mois. En cas de malformation de l’ulna, ou encore de croissance assymétrique entre le radius et l’ulna (défaut ou excès de croissance de l’un ou l’autre), la fusion ne se fait pas. Le processus anconé reste mobile et les frottements provoquent une inflammation.
- Fragmentation du processus coronoïde médial : le processus coronoïde est une petite saillie osseuse située sur l’ulna. S’il vient à se détacher (par exemple, suite à un défaut de croissance du radius), ce fragment irrite la surface articulaire (inflammation) et vient user le cartilage adjacent de l’humérus.
- Incongruence articulaire : les surfaces articulaires ne s’emboîtent pas parfaitement (suite à un défaut de croissance d’un os, à une malformation osseuse…), ce qui entraîne des pressions anormales sur l’articulation.
Toutes ces anomalies conduisent au développement d’arthrose*. La douleur, parfois très vive, est systématique. En l’absence de traitement, l’atteinte arthrosique progresse irrémédiablement, aggravant la douleur et la gêne fonctionnelle pour se déplacer. Le pronostic vital n’est toutefois pas engagé.
Les signes cliniques
L’apparition pendant la croissance d’une boiterie touchant un ou les deux membres antérieurs constitue généralement le premier signe d’appel pour la dysplasie du coude. Cependant, lorsque l’atteinte est peu sévère, la boiterie peut n’apparaître qu’au bout de plusieurs années, avec le développement d’arthrose, voire jamais.
Le chien peut également tenir son coude éloigné du corps, ou présenter une légère rotation externe du membre atteint.
L’animal doit sans tarder être présenté au vétérinaire, qui étayera la suspicion en examinant et en manipulant l’articulation. Le praticien confirmera son diagnostic en réalisant plusieurs radios du coude. Il peut également s’appuyer sur le scanner et l’arthroscopie.
Les images ainsi obtenues lui permettront de préciser la nature des lésions, et la gravité de la dysplasie.
La grille de notation de la dysplasie du coude comprend 5 grades, en fonction de la présence de lésions primaires et/ou de la présence d’arthrose :
- Grade 0 = Coude normal, chien indemne
- Grade SL = Stade Limite (presque normal) : coude avec de très légers défauts
- Grade DC1 = Arthrose légère
- Grade DC2 = Arthrose modérée et altération modérée du tissu osseux
- Grade DC3 = Arthrose sévère et altération importante du tissu osseux
Le traitement
Lorsque le diagnostic est réalisé pendant la phase de croissance, avant que l’arthrose ne se soit développée, un traitement chirurgical est généralement indiqué. Il permet de corriger les anomalies observées afin d’éviter que l’arthrose ne se développe. La nature de l’intervention varie en fonction de l’atteinte primaire. Dans certains cas, un simple rinçage de l’articulation (sous arthroscopie) permet d’éliminer les débris à l’origine du trouble.
Lorsque l’arthrose est déjà bien en place, le succès de l’intervention chirurgicale est plus aléatoire. Le vétérinaire peut préférer la mise en place d’un traitement conservateur, basé sur l’administration de médicaments antidouleur (anti-inflammatoires), de suppléments nutritifs ralentissant l’évolution de l’arthrose (chondroprotecteurs), et la modification du mode de vie du chien : contrôle du poids, activité physique adaptée.





